
香港大学新发传染性疾病国家重点实验室及香港大学李嘉诚医学院(港大医学院)临床医学学院微生物学系周婕博士与袁国勇教授团队,联同类器官先驱、荷兰Hubrecht Institute的Hans Clevers教授及复旦大学姜世勃教授利用人呼吸道类器官模型,评估Omicron BA.5及其他变异株在人体呼吸道细胞中感染和复制能力。
研究结果已发表于最新一期的《美国国家科学院院刊》(PNAS)。
新冠病毒变异株在世界各地引发了多次感染高峰。其中,Omicron变异株于2021年11月在南非首次发现,并迅速在全球传播。
然而,科学家也在思考另几个重要议题:新冠病毒在演变过程中,是否强化了其在人类呼吸道细胞内生长复制的能力,导致传播能力增强?Omicron变异株是否已在人类呼吸道细胞内适应了?
要回答这些问题,需要一个可以模拟人类呼吸道上皮的体外模型,以测试病毒在人类呼吸细胞中的感染和复制。
周婕博士及袁国勇教授团队与Hans Clevers教授合作,建立了全球首个源自肺成体干细胞及鼻腔细胞的呼吸道类器官培养系统。这些呼吸道类器官可以连续稳定地扩增半年至一年的时间。团队将长期扩增培养的类器官诱导分化,建立了成熟的鼻粘膜、气道和肺泡类器官(PNAS 2018,Cell Discovery 2022,mBio 2022)。
这全新的呼吸道类器官培养系统使科学家能够在培养皿中高效而稳定地建立及扩增整个人类呼吸上皮组织,这些呼吸道类器官成为研究呼吸道生物学,以及包括COVID-19在内相关疾病的最佳工具。
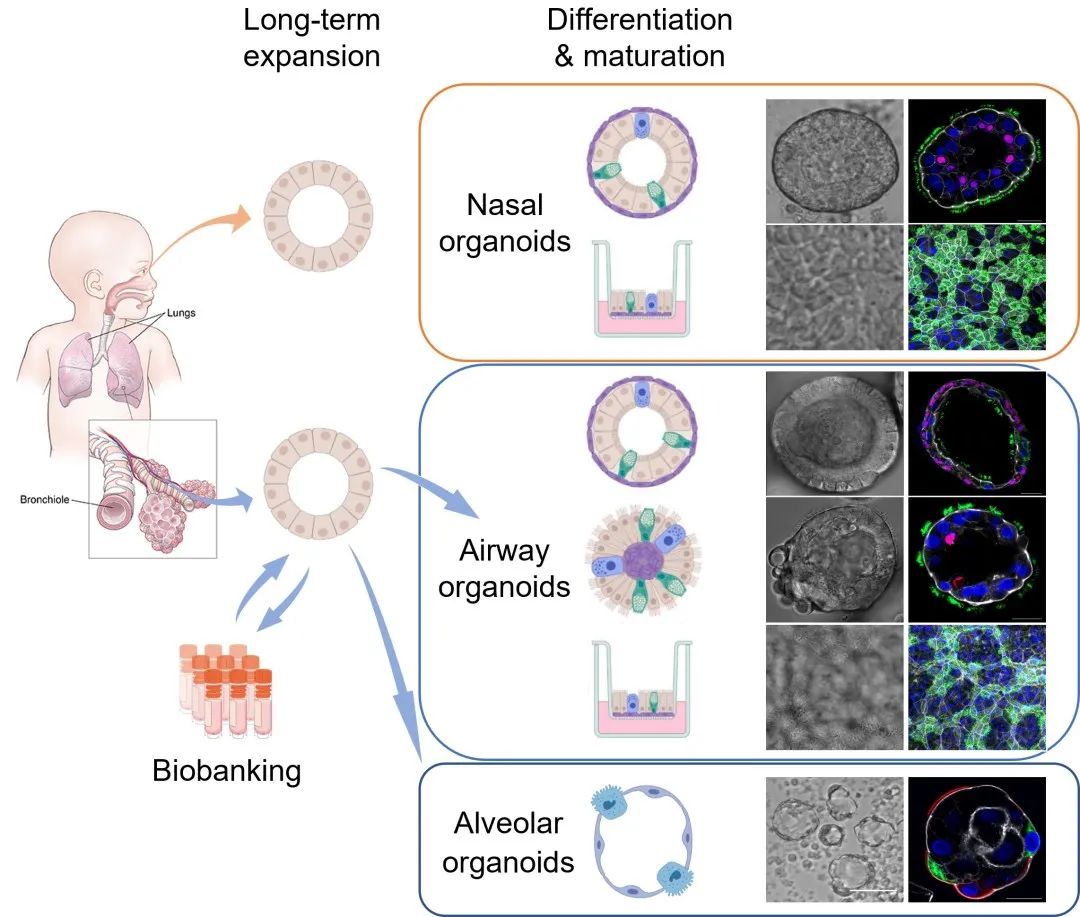
团队将长期扩增培养的呼吸道类器官诱导分化,建立了成熟的鼻粘膜、气道和肺泡类器官。
研究团队首先在气道类器官及鼻粘膜类器官中研究原始病毒株(WT)、两种Omicron变异株B.1.1.529和BA.5的感染和复制情况。结果显示,BA.5感染类器官后产生的病毒滴度比WT和B.1.1.529更高,更达到与造成流感大流行的甲型流感病毒H1N1(H1N1pdm)相当的复制能力。
团队将病毒感染后的类器官进行了免疫染色和共聚焦成像。结果指出BA.5感染的鼻粘膜和气道类器官中,病毒阳性细胞的数量明显比B.1.1.529和WT增多。
除此之外,团队亦发现BA.5感染后的气道类器官和鼻粘膜类器官可以形成典型的多核合胞体,而WT和B.1.1.529的感染并不能产生合胞体。
总体来说,BA.5的高感染效率和融合活性使人鼻粘膜和气道细胞形成合胞体并促进病毒的扩散,从而显著增强了感染力和传播力。
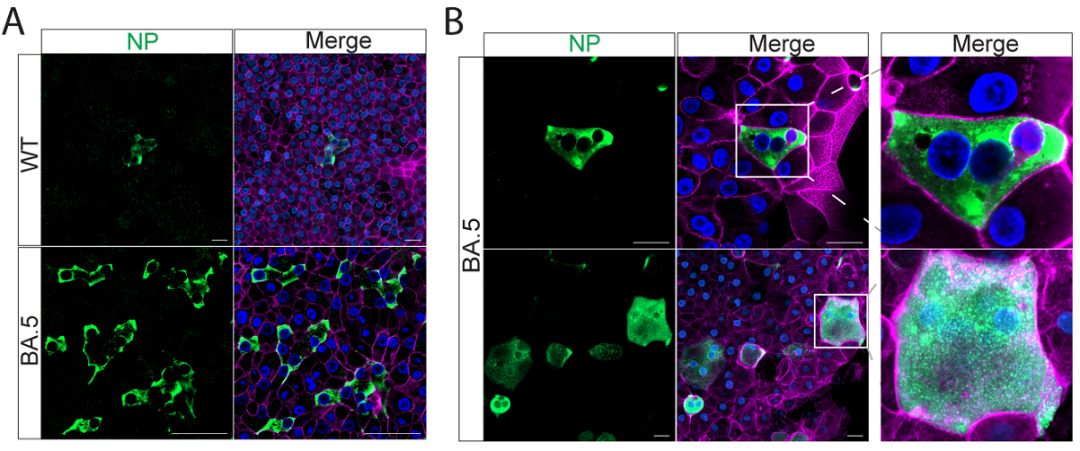
鼻粘膜类器官分别以0.01MOI的病毒量感染SARS-CoV-2 WT和BA.5。感染BA.5的鼻粘膜类器官中病毒(NP+)的阳性细胞数量明显比感染WT的类器官中为多(图A)。而且感染BA.5的类器官中会明显地出现典型形态的合胞体(图B)。
早前已有大量研究指出Omicron的高传染性是由于免疫逃逸。
周婕博士及袁国勇教授团队表示:
此研究让团队从全新视角揭示BA.5变异株超强感染性和传播能力的机制,为公共卫生政策的实行提供了科学依据。团队建立的呼吸道类器官培养系统可以广泛地应用于呼吸系统生理和疾病的研究。
这项研究由港大医学院临床医学学院微生物学系助理教授周婕博士和传染病学讲座教授袁或勇教授、荷兰Hubrecht研究所Hans Clevers教授、复旦大学姜世勃教授领导。港大医学院临床医学学院微生物学系研究助理教授李存博士、博士生黄晶晶、俞亦飞和万智信为该研究的共同第一作者。

港大医学院揭示新冠病毒BA.5变异株高度传染的机制。团队成员包括:(从左至右)俞亦飞、黄晶晶、李存博士、万智信、周婕博士、袁国勇教授、赵文俊博士、朱晓鑫和张舒心。
其他参与作者包括港大医学院临床医学学院微生物学系博士后赵文俊、博士生刘晓娟、研究助理张舒心、助理专职研究员蔡建飘、助理教授朱轩博士、临床副教授陈福和医生、系主任及临床教授杜启泓教授:南方医科大学南方医院李刚教授;以及广州医科大学附属第一医院广州呼吸健康研究院杨子峰教授。








